Kontaktinformation
Patrik Bohman, miljöanalytiker
Institutionen för akvatiska resurser, Sötvattenslaboratoriet, SLU
patrik.bohman@slu.se, 010-478 42 17

Vatten innehåller fragment av DNA från fisk, kräftor och musslor. Kan ett vattenprov visa vilka arter som lever i en sjö? Vi testar och utvecklar eDNA-metoden som ett komplement inom traditionell miljöövervakning.
eDNA kommer från engelskans ”environmental-DNA” och är den blandning av organismers DNA-fragment som förekommer i vatten. Det kan röra sig om allt ifrån levande djur eller djurdelar, till exempel ägg, spermier och larver. Men även dött material som avföring, slem, fiskfjäll eller fritt flytande DNA-molekyler. Tekniken att kunna matcha rätt organismer med DNA i ett vattenprov har utvecklats snabbt under de senaste åren.
Man använder markörer för artspecifika DNA-sekvenser, och förstärker mängden prov-DNA med hjälp av PCR. Slutligen matchas resultatet mot existerande bibliotek av arters DNA-sekvenser, vilket gör det möjligt att finna olika arter i fältprovet. Biblioteken har utökats med 1000-tals nya artspecifika DNA-sekvenser.
Det finns all anledning att utveckla metodiken då den är enkel, precis och dessutom kostnadseffektiv. Metoden kan framför allt komplettera miljöövervakning av sötvattensfisk, insjökräftor och stormusslor.
Följande miljöövervakning kan kompletteras med eDNA-metoden:
eDNA genom vattenprovtagning är en icke-förstörande metod, för både miljö och arter, vilket i framtiden kommer att bli alltmer betydelsefullt.
Den invasiva arten solabborre (Lepomis gibbosus) upptäcktes i en damm vid Kungsbacka i Hallands län sommaren 2018. Det var en boende i området som hittade döda solabborrar i en uttorkad åfåra den 16 juli. Två dagar senare, den 18 juli, elfiskade Länsstyrelsen i Hallands län tillsammans med SLU (Artdatabanken) ett antal lokaler i och nedströms dammen. Man fann mängder av reproducerande individer i dammen, samt en levande solabborre nära utflödet vid Lillån, vilket innebar en förhöjd spridningsrisk till närliggande vatten. Strax efteråt kontaktades institutionen för akvatiska resurser (SLU Aqua) av Havs- och vattenmyndigheten i ett försök att spåra solabborren med hjälp av eDNA. SLU Aqua drev det nu avslutade projektet med hjälp av SeAnalytics i Göteborg. Dammen vid Kungsbacka tömdes av markägaren med uppsikt från Länsstyrelsen i Hallands län några veckor efter att fyndet blivit känt.
Med hjälp av eDNA-teknik kan vi spåra solabborrens rörelser i området kring Kungsbacka. Provtagning genomfördes i Kungsbackaån, Lillån och närliggande vattendrag (Skårsjöån, Rolfsån, samt kanalen mellan Kungsbackaån och Rolfsån) under sommaren 2018. Vattenproverna har senare analyserats med hjälp av ”ddPCR”. ddPCR är en förkortning av ”droplet digital PCR”, som är en noggrann och mycket specifik metod för att till exempel spåra mycket låga halter DNA i vattenprover.
Resultat från analyserna visade att solabborre inte fanns i de vatten och höljor som provtogs med avseende på eDNA. Det ska dock påpekas att vid ett elfiske i september 2018 så fångades flera solabborrar ca 1,5 km nedströms själva utsättningsdammen. Det finns därmed en förhöjd risk att arten sprider sig vidare nedströms och ut i Lillån/Kungsbackaån.
Beslut om en eventuell uppföljning av projektet 2019 tas av Havs- och vattenmyndigheten.
Projektet är publicerat i SLU Aquas rapportserie (Aqua reports 2018:21 Jakten på solabborren (Lepomis gibbosus) - En eDNA-studie i Kungsbackaån).
Solabborren kommer ursprungligen från Nordamerika, men är numera utbredd i flera europeiska länder (närmast Norge, Danmark och Tyskland).
Fisken trivs i lugnflytande vatten, ofta med dålig sikt och dyig botten med mycket vegetation (eutrofa vatten).
Arten kan sprida parasiter och virus till andra organismer och kan uppvisa revirhävdande, aggressivt beteende mot andra arter. Solabborre har också visat sig konkurrera om föda med andra arter, samt kan äta andra fiskars ägg. Arten säljs ofta olagligt som vacker akvariefisk. I Nordamerika kan fisken bli upp till 30 cm och sportfiskas eller används som levande bete.
Fältförsök genomfördes i de fyra sjöarna Mälaren, Öre sjö, Norasjön och Stensjön, samt i Svartälven och Svennevadsån. I samtliga vatten var förekomster av musslor, kräftor och fisk väl kända genom tidigare inventeringar. Vattenprover togs på olika lokaler och på olika djup. Sammanlagt togs 10 prover per vattenobjekt (50 L/lokal), samt några 0-prov, totalt ca 70 stycken 5-litersprover. Provtagningen utfördes med Rambergsrör (djup >0,5 m) eller direkt i flaska (yta).

Vakuumfiltrering genom DNA-filter (0,45um) genomfördes samma dag som provtagningen. Filtrena frystes och analyserades senare på Naturhistoriska Riksmuseet i Stockholm. Här genomfördes DNA-extraktion (MoBio PowerWater DNA kit) och traditionell PCR. Sekvensering genomfördes vid SciLifeLab i Uppsala. 16S användes som genmarkörer vid PCR och sekvensering.
Resultaten från analyserna var nedslående och endast en bråkdel av förekommande arter kunde detekteras. Provtagningsrutiner och laboratorieanalyser måste därmed förbättras. Vi måste också bättre hantera kontamination under provtagning och filtreringsfas. Rapporten från CGI kan hämtas här (länk).
Akvarieförsök genomfördes på SLU Aqua vid Drottningholm. Flera arter (av fisk, kräftor och musslor) blandades i genomströmmande akvarier. Med en förbättrad kontroll av kringliggande miljö kunde vi utveckla bättre metoder för att hitta våra målarter.
Under 2015 togs vattenprover i samma vatten (4 sjöar och 2 vattendrag) som under 2014. Metodiken under 2015 ändrades något och en ”kontaminationsfri” vattenhämtare (Limnos/Hydro-Bios) användes och vattnet förvarades i 2 x 1-liters flaskor. Vattenproven frystes ned efter provtagning, vilket minskade kontaminationen som uppkommer vid vakuumfiltreringen.

Kontaminationsfri vattenhämtare ”Limnos” från Hydro-Bios.
Vattenproverna tinades i kallvattenbad, DNA extraherades med DNeasy Blood & Tissue DNA Kit (en betydligt mer effektiv extraktionsmetod än MoBio PowerWater DNA kit). Protokoll från DNA-laboratoriet beskrivs i resultatrapporten. Både traditionell PCR och qPCR användes.
Resultaten från 2015 var betydligt bättre jämfört med 2014, eftersom vi prövade ut protokollen mer noggrant. Flera tester utfördes i samband med utveckling av nya eDNA-protokoll. Rapporten från CGI kan hämtas här.
Fältförsöken utfördes under 2016 med en helt ny metodik (filterkapslar: Sterivex 0,45µm och Envirochek 1,0 µm) där kapslarna kontaminationsfritt kan filtrera vatten från flera platser. Fördelen med kunna ta ackumulerade prover är att vi ökar träffbilden för målarterna. Vattenprover hämtades upp med 1 litersflaskor och filtreringen genomfördes direkt i fält. En peristaltisk pump (MasterFlex EasyLoad från Cole-Parmer) användes tillsammans med en vanlig skruvdragare. Filterkapslarna hölls frysta fram till DNA-extraktion.
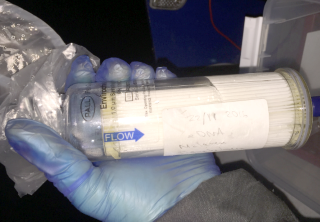
a. Filterkapsel Envirochek.

b. Filterkapsel Sterivex med peristaltisk pump och skruvdragare.
Filtren tinades och urlakning genomfördes med hjälp av DNeasy Blood & Tissue DNA Kit. Traditionell PCR och qPCR genomfördes efter strikta protokoll. Sekvensering kommer att utföras av LifeScience Lab i Uppsala.
Resultaten har analyserats, men vi fick problem med både extraktionen från filterkapslarna och då vi skapade sekvenseringsbibliotek. Eftersom dessa delar är centrala för en lyckad matchning av de arter som förekommer vid provtagningsplatserna, så blev resultatet negativt. Det innebar att vi inte kunde avläsa några DNA-fragment och därmed inte kunde hitta några arter i våra prover.
Här kommer underlag och förslag på lösningar på problemen:
Trots att vi fick ”negativa” resultat under vårt sista år i projektet, så visade sig eDNA-metodiken ändå vara en kraftfull och intressant metod inom miljöövervakningen. Det kvarstår en hel del, bl.a. måste man hitta robusta verifieringsmetoder för att kontrollera resultaten från eDNA-undersökningar.
Under 2018 kommer projektet att producera en rapport över eDNA och dess användbarhet inom miljöövervakningen. Rapporten riktar in sig på fisk, kräftor och musslor i sötvatten. Huvudsakliga frågeställningar inkluderar:
Denna eDNA-rapport publiceras på SLU Aquas webb i september 2018, som en Aqua reports.
Projektet har finansierats av Sveriges lantbruksuniversitet och Forska Utan Djurförsök.
Den nya handledningen eDNA i en droppe vatten - Vattenprovtagning av DNA från fisk, kräftor och musslor beskriver hur du praktiskt spårar olika arter i sötvatten i ett vattenprov. Handledningen rekommenderar metod, undersökningsupplägg, hur du skriver avtal med laboratorier och analyserar data. Den ger dig också vägledning bland de metoder som används idag.
- Det kan kännas som en djungel att välja metod, eller att hänga med i vad som behövs göras i en eDNA-undersökning. Därför har vi skrivit den här handledningen, och jag hoppas den blir användbar i olika projekt, säger Patrik Bohman på institutionen för akvatiska resurser (SLU Aqua).
En fördel med eDNA-metodiken är att den är icke-förstörande. Man behöver alltså inte provfiska och ta upp fisken för att kunna göra en enklare biodiversitetsundersökning eller för att upptäcka invasiva, främmande arter i ett vatten. Metodiken passar därmed bra i svårinventerade och känsliga miljöer.
- eDNA skapar nya möjligheter inom miljöövervakningen och är väldigt hett just nu. eDNA är idag ett perfekt komplement till våra provfisken, och kan ge oss mer data vid biodiversitetsundersökningar eller vid övervakning av främmande eller sällsynta arter. Det finns flera företag som utför provtagningar och analyser. Men metoden kan inte svara på alla frågor, vilken den som beställer en undersökning från en utförare bör vara medveten om, säger Patrik Bohman.
eDNA säger till exempel inte någonting om storleks- eller könsfördelning i ett fiskbestånd, och den ger inga indikationer på skador eller hälsostatus. Det är också svårt att beräkna hur stora bestånden är, något som är mycket viktigt inom miljöövervakningen.
- eDNA-metodiken behöver också tydligare riktlinjer för att kunna verifieras och för att undersökningarna ska kunna upprepas på likvärdigt sätt. Idag utförs eDNA-studier på många olika sätt vilket försvårar detta arbete, men flera olika grupper arbetar också för att standardisera viktiga delar, till exempel DNAqua-Net, säger Patrik Bohman.
Patrik Bohman, miljöanalytiker
Institutionen för akvatiska resurser, Sötvattenslaboratoriet, SLU
patrik.bohman@slu.se, 010-478 42 17